Nature子刊:张华凤/高平/孙林冲揭示线粒体定位的MBD2c蛋白促进mtDNA转录和化疗耐药
来源:生物世界 2024-12-06 09:47
该研究首次发现甲基结合蛋白MBD2c可以定位至线粒体基质并与线粒体基因组中的NCR结合,并与SIRT3/TFAM形成三元复合物促进mtDNA转录和线粒体呼吸代谢,从而增强乳腺癌细胞对顺铂的化疗耐药。
中国科学技术大学张华凤课题组和南方医科大学/广东省人民医院高平/孙林冲课题组合作,在 Nature Chemical Biology 期刊发表了题为:Mitochondria-localized MBD2c facilitates mtDNA transcription and drug resistance 的研究论文。
该研究发现,线粒体中的MBD2c蛋白通过促进线粒体基因转录增强乳腺癌细胞对化疗药物顺铂的耐药性。机制解析表明, MBD2c与去乙酰化酶SIRT3结合并使TFAM发生去乙酰化,进而上调mtDNA编码蛋白的表达。同时,该研究还发现,在化疗药物顺铂的处理下,MBD2c通过维持mtDNA的表达及细胞内的氧化还原稳态提高乳腺癌细胞的耐药性,为临床乳腺癌的治疗和诊断提供了潜在的新靶点。

在这项最新研究中,研究团队通过DNA pull-down联合IP-MS寻找可结合线粒体基因组NCR的潜在调节因子,筛选发现甲基结合蛋白MBD2的剪切体MBD2c与线粒体NCR之间存在显著结合。甲基CpG结合域(MBD)蛋白通常结合CpG岛上的甲基化位点,是核小体重构和组蛋白去乙酰化(NuRD)复合物的核心组分。MBD2c是MBD2经选择性剪接产生的不含C端TRD(转录抑制结构域)的一个截短蛋白质,其最初被发现可与全长的MBD2a共同调控诱导多能干细胞(iPSC)的干性。该团队前期研究发现MBD2a通过下调糖酵解途径抑制多能干细胞的重编程,并且MBD2a和MBD2c在乳腺癌细胞的转移调控中发挥相反的作用。但是目前尚不清楚MBD2c是否以及如何调控线粒体的功能。
通过分离不同细胞系的细胞器组分发现,MBD2c在多种肿瘤细胞及正常的永生化细胞中存在线粒体定位。此外,MBD2c的C端与TOM20结合,并在其作用介导下定位于线粒体基质。ChIP-seq结果显示MBD2c与mtDNA的NCR区域有明显的结合,提示线粒体定位的MBD2c可能通过结合NCR调控线粒体功能。
进一步研究发现,MBD2c在转录水平正调控mtDNA编码基因的表达,并最终促进mtDNA编码蛋白的表达及线粒体呼吸。通过解析线粒体定位的MBD2c调控mtDNA转录的分子机制发现,线粒体中的MBD2c,去乙酰化酶SIRT3和TFAM之间存在蛋白-蛋白相互结合,进而MBD2c通过SIRT3使TFAM蛋白Linker结构域的145&146位点赖氨酸发生去乙酰化。在低乙酰化状态下,TFAM中带正电荷的linker结构域可以更高效的与DNA磷酸基团结合,从而增强TFAM与NCR的结合并促进mtDNA的转录及线粒体的氧化呼吸。
化疗药物,例如顺铂(CDDP)广泛应用于临床乳腺癌等多种实体瘤的治疗,但容易产生耐药。mtDNA是顺铂的优先靶点之一;该研究发现MBD2c介导的线粒体转录、线粒体活性及细胞内的氧化还原稳态参与顺铂耐药机制的形成。此外,研究人员将顺铂与MBD2蛋白抑制剂KCC-07联用,发现抑制MBD2c可以显著提升乳腺癌细胞对顺铂的敏感性,提示线粒体定位的MBD2c是导致肿瘤细胞对顺铂产生耐药的重要原因之一。
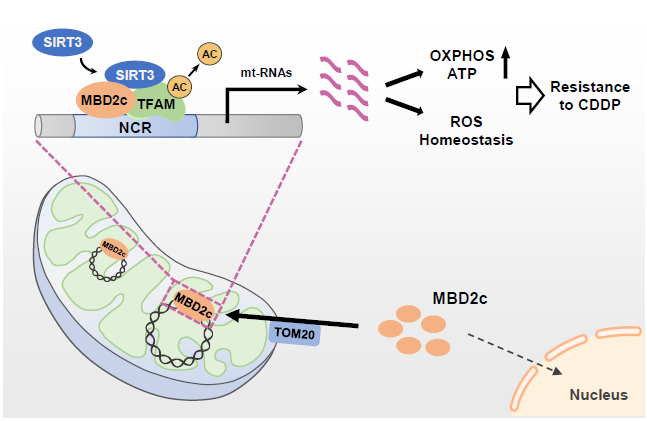
图1. MBD2c通过激活线粒体转录促进线粒体氧化呼吸并维持氧化还原稳态从而诱导肿瘤耐药
综上所述,该研究首次发现甲基结合蛋白MBD2c可以定位至线粒体基质并与线粒体基因组中的NCR结合,并与SIRT3/TFAM形成三元复合物促进mtDNA转录和线粒体呼吸代谢,从而增强乳腺癌细胞对顺铂的化疗耐药。该研究拓展了细胞核编码蛋白通过细胞器易位调控线粒体内部基因表达的分子机制,阐述了线粒体定位的MBD2c是导致临床乳腺癌患者对顺铂产生耐药的原因之一,并为MBD2c作为治疗靶点或诊断生物标志物的临床转化提供了研究基础。
中国科学技术大学郝仡杰博士、博士研究生周子龙为论文共同第一作者,张华凤教授,高平教授以及孙林冲副研究员为共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


